Vă propun un exemplu de exercițiu, de nivel mediu, pentru învățarea măsurilor de protecție a muncii în laboratorul de chimie.
IDEE DE AFACERE ÎN ECOTURISM RURAL LA CECĂLACA, ROMÂNIA
GOSPĂDĂRII ȚĂRĂNEȘTI TRADIȚIONALE DIN SATUL CECĂLACA, JUDEȚUL MUREȘ, ROMÂNIA
Vreau să vă fac cunoscută, ideea de afacere în ecoturism rural, a familiei Balog Ionela si Bela, din satul Cecălaca, județul Mureș. Tema este dezvoltată, în cadrul activității A3.2 ”Activități de informare și conștientizare grup țintă”, din proiectul SCOP.OM, care are datele de identificare de mai jos:
- Proiect de parteneriat, din cadrul Programului Operațional Capital Uman, Axa prioritară 6-Educație și competențe Prioritatea de investiție 10.iv
- Contract POCU/663/6/14/ ID131628
- Codul proiectului: 131628
- Titlul proiectului: ” SCOP.OM – Stagii de practică, Consiliere si Orientare Profesională pentru elevii din învățământul profesional si tehnic din Ocna Mures”
- Beneficiar: SC INFO MIAD SRL,Cimpia Turzii scopom@infomiad.ro
- Partener 1 Liceul Tehnologic Ocna Mures gsci2001@yahoo.com
Motto:
”Vindem natura, ca să o salvăm”
anonim
RECUNOAȘTEREA UNOR ANIONI
FIȘA DE LUCRU
IDENTIFICAREA UNOR ANIONI:
Cl–, CO32-, SO42-; S2-; PO43-; NO3–;NO2–, CH3COO–
Bibliografie
1.Mihail Iușut, Probleme de chimie generală și anorganică, Editura Tehnică, București, 1981
2.http://www.math.md/stireal/chimie/candidat/anioni_1.pdf
3. http://schrct.univ-ovidius.ro/res/Default/universul_chimiei_nr2.pdf
INDICAȚII
Anionul este un atom sau un grup de atomi, care au sarcina electrică negativă, fiindcă au primit unul sau mai mulți electroni în plus.
Identificarea anionilor se face cu reactivi, de genul: a) conțin cationi, care conduc în urma reacției cu anionul respectiv, la complecși colorați, substanțe greu solubile; b) substanțe organice, care formează cu anionul compuși organici colorați.
EXERCIȚII REZOLVATE
Exercițiul 1
În patru eprubete neetichetate se presupune, că sunt soluții de:AgNO3, NaHCO3, Na2S, CH3COOK. Folosind numai soluție de HCl 2N, identificați conținutul fiecărei eprubete.
Rezolvare.
Se iau în patru eprubete numerotate cu 1,2,3,4 câte 1 mL din fiecare soluție și se toarnă, aproximativ 1 mL de soluție de HCl, 2N. Se notează observațiile și se identifică numele soluției, după acestea (vezi tabelul de mai sus).
Figura 1. Identificarea soluțiilor
Exercițiul 2
Un test, pentru recunoașterea prezenței ionului NO3– este reacția cu soluție concentrată de FeSO4 și H2SO4 concentrat din care rezultă un complex de nitrozil FeSO4. NO. Complexul apare sub forma unui inel brun.
Figura 2 https://images.app.goo.gl/DvAETZQ8EfDFD6ay5
Cerința:♦♦♦
Stabilește coeficienții stoechiometrici ai ecuației chimice redox, care are loc, dacă proba este NaNO3:
…NaNO3 + …H2SO4 +… FeSO4 →…Fe2(SO4)3 +…(FeSO4.NO)inel +… Na2SO4+…H2O
Semireacțiile redox sunt:
Fe2+ -1e– → Fe3+ oxidare
N5+ + 3 e– →N5+ reducere
Exercițiul 3
In două eprubete neetichetate ai soluție de Na2SO4 și respectiv de Na2S. Folosind un singur reactiv, identifică soluția din fiecare eprubetă. Scrie ecuațiile reacțiilor chimice propuse.
Rezolvare
Reactivul folosit este soluția de (CH3COO)2Pb, pentru identificarea anionilor SO42- și respectiv S2-.
Se pun în fiecare eprubetă, aproximativ 1 mL de soluție de (CH3COO)2Pb și se notează observațiile.
–dacă apare un precipitat alb, în aceea eprubetă este anionul SO42-, adică soluția de Na2SO4.
Reacția chimică este:
(CH3COO)2Pb+Na2 SO4 → 2 CH3COONa + PbSO4↓ alb
***
–dacă apare un precipitat negru, în aceea eprubetă este anionul S2-, adică soluția de Na2S
(CH3COO)2Pb+Na2S →2CH3COOH + PbS↓ negru
ANALIZA GRAVIMETRICĂ A PALADIULUI PRIN PRECIPITARE CU DMG
Este un instrument de lucru on-line, o primă încercare, o variantă personală, cu indicarea notelor bibliografice. Se referă la recunoașterea numelui ustensilelor din această analiză gravimetrică; de exemplu: ”Creuzet filtrant”. Cuvântul începe cu litera mare. Nu trebuie, să-mi trimiți fișa rezolvată. Te autoevaluezi!

OBȚINEREA SCANDIULUI PRIN ELECTROLIZA CLORURII DE SCANDIU TOPITE





SUGESTII PENTRU REZOLVAREA PROBLEMELOR DE CHIMIE, CLASA A XII-a CAPITOLUL *REACȚII DE OXIDO-REDUCERE*
Bună ziua!
Vă propun aceste variante pentru rezolvarea unor probleme din Manualul de Chimie, pentru clasa a XII-a C1.
Nu contrazic, alte variante studiate la curs și dacă am erori, vă rog să mă anunțați. Vreau, să ajut, cu ce știu!
Maria Elena Udrea, profesor
Liceul Tehnologic Ocna Mureș
21 martie 2020
Bibliografie
1.Luminița Vlădescu, Irinel Adriana Badea, Luminița Irinel Doicin, Maria Nistor, Chimie, manual pentru clasa a XII-a , C1, Editura Grup Editorial Art, 2006
2.Programa pentru bacalaureat la chimie
Legendă:
►M=masa molară (moleculară); se mai notează cu μ; (g/mol);
►m=masa de substanță, (g);
►A=masa atomică (sau masa molară atomică), (g/mol atom);
►n=număr de moli;
►V=volum (L)
►d=densitate,(g/mL)
►Vm=volum molar. Volumul molar este volumul ocupat de 1 mol de gaz, în condiții normale (c.n.), la t=0 grade C și presiune de 1 atm și are valoarea de: Vm=22,4 L(dm3 )/mol gaz=22,4 m3/kmol gaz
►γ =coeficient stoechiometric=o cifră scrisă în fața simbolului chimic, respectiv în fața formulei chimice, egală cu numărul de atomi sau molecule participante în ecuația chimică;
►E=echivalent chimic;
►Eg=echivalent- gram (g/Eg);
►K=echivalent electrochimic=A/z. F
unde:
A=masa atomică a elementului chimic; z=numărul de electroni implicați în procesul de oxido-reducere ( se notează și n);
F=numărul lui Faraday, F=96500(96487)C/Eg=96500C/1 mol e
I=intensitatea curentului electric, (A); A-Amper
t=timp,( s);s=secundă
►celula electrochimică=un dispozitiv, în care se găsesc doi sau mulți electrozi imersați într-o soluție sau într-o topitură de electrolit și în care au loc reacții de oxido-reducere, ce vor determina tipul lor: pile (elemente galvanice) sau celule de electroliză.
►element galvanic=un tip de celulă electrochimică, în care energia chimică este transformată în energie electrică. Se mai numesc, pile, celule, de exemplu:. Pila lui Daniell, pila lui Alessandro Volta, acumulatorul cu Pb (H2SO4), pila Leclanche, pile din legume/fructe, pile uscate Zn-C și cu Hg, etc. Este un proces spontan.
►celula electrolitică=celula de electroliză (baie)=un tip de celulă electrochimică, în care energia electrică se consumă pentru a produce o reacție redox. Procesul, care are loc în acest dispozitiv este electroliza unui electrolit (soluție sau topitură) și este un proces impus.
►Oxidarea=procesul chimic în care un atom cedează electroni, în urma căruia crește numărul lui de oxidare;
►Reducerea=procesul prin care un atom acceptă electroni, în urma căruia numărul lui de oxidare scade.
►N.O= număr de oxidare
►Electrod=metal sau nemetal, introdus într-o soluție sau topitură de electrolit din pilă, respectiv din celula de electroliză. Pe suprafața lui de separare cu lichidul apar procese de oxido-reducere reversibile sau ireversibile. Se lucrează cu o pereche de 2 electrozi: anod și catod
►anod (-)= electrodul din celula electrochimică, la care are loc procesul de oxidare. Prin convenție i se atribuie semnul algebric – . La electroliză, anodul este legat la polul pozitiv al sursei de curent.
►Catod (+)= electrodul din celula electrochimică, la care are loc procesul de reducere. Prin convenție i se atribuie semnul algebric +. La electroliză, catodul este legat la polul negativ al sursei de curent.
►E catod=potențial redox al catodului=E(+), (V);
►E anod= potențial redox al anodului=E(-), (V)
►E cel= potențial redox al celulei electrochimice sau tensiunea electromotoare (f.e.m) sau forța electromotoare, (V)
►E cel = E catod-E anod= E(+)-E(-)
►V=volți
►Seria potențialelor electrochimice (tensiuni)=seria Beketov-Volta= seria potențialelor de reducere standard pentru electrozi reversibili, (25 grade C, p=1 atm, C soluție=C ion=1 Eg substanță/1 l soluție) o așezare a cuplurilor redox în ordinea creșterii potențialelor redox standard:
***************************************************************************
-
- Pagina 69
Problema 2.Cât timp trebuie să treacă un curent de 4 A printr-o soluție de CuSO4 în care este introdusă o placă cu suprafața de 100 cm2, pentru a se acoperi cu un strat gros de 1 mm Cu.
Densitate Cu= 8,39 g/cm3
Ce trebuie să facem?
În expresia matematică de la prima lege a electrolizei, introducem datele numerice cunoscute ale mărimilor fizice și calculăm timpul de lucru.
m=K. Q; m=1/F.(A/z).I.t, unde:
m=masa teoretică de substanță (g)
F=numărul lui Faraday=96500 C/Eg subst.=96500 C/mol e–
A/z=echivalentul chimic al elementului chimic, g/Eg
1C=1A.1s
I=intensitatea curentului electric, A
t=timpul de electroliză, s sau h, cum este exprimat F
Dar este important să calculăm, prima dată masa de Cu depus, m, cu ajutorul densității, d, și al volumului, V. Volumul plăcii va fi calculat.
d=m/V
Calcule:
1)Volum plăcii de Cu în urma depunerii=? cm3 Deducem că placa după depunerea de Cu are forma unui paralelipiped:□
V paralelipiped= Ab. h= 100cm2. 1.10-1 cm=10 cm3
2)Masa Cu depus=? g /din densitate
d=m/V, m=d. V
m Cu=8,39 g/cm3.10 cm3=83,9 g
3)Timpul de lucru, t=? Introducem valorile numerice în relația matematică și rezolvăm:
K Cu = 64/2.96500=32/96500
83,9 g=32.4A.t /96500A.s.
83,9.9650=128.t
T=83,9.96500/128=63252,73 s=17,57 h
R: 17,57ore
Problema 3 Se trece aceeași cantitate de electricitate prin soluții de AgNO3 și Cr(NO3)2. Știind că în prima celulă se depun 3,60 g de Ag, calculează masa de crom depusă în cea de a doua celulă.
Varianta 1 cu legea I a electrolizei
Ce trebuie să facem?
–să înțelegem ce semnifică indicația, ”că aceeași cantitate de electricitate produce depunerea de 3,6 g Ag și o cantitate necunoscută de Cr”?
☺ De la această indicație începe rezolvare problemei, adică aflarea masei de Cr care se depune!!!
Q consumat pentru depunerea de 3,6 g Ag=Q consumat pentru depunerea unei cantități de Cr, pe care o notăm cu X.
–să aplicăm legea I a electrolizei
m=K.Q
Calcule
1.Calculăm Q, cu legea I a electrolizei,dacă se obțin 3,6 g Ag și X g, de Cr:
Q/AgNO3= m Ag/Ke Ag
Q/Cr(NO3)3=m Cr/Ke Cr
Unde:
m Ag=3,6 g,
K Ag= A Ag/n.96500
A Ag=108 g/mol. atom
z=1 e transferat, Ag+ + 1 e- =Ag0
m Cr=X
K Cr=A Cr/z.96500
A Cr=52 g/mol. atom
z=3 e, acceptați; Cr3++ 3e–= Cr0
2.Egalăm cele două relații și din proporția formată calculăm X.
Q /AgNO3=Q/Cr(NO3)2
ð3,6 /108 /96500 = X/(52:3).96500
3,6/1.(96500/108)=X/1. (96500.17,33)
3,61/108=X/17,33
X=3,6.17,33/108=0,577 g Cr, aprox. 0,58 g Cr
Varianta 2 cu legea a II-a a electrolizei
Când, cantitatea de electricitate este aceeași la electroliza, celor două soluții de AgNO3 și Cr(NO3)3, atunci numărul de echivalenți electrochimici de Ag și Cr formați este egal:
n K Ag=n K Cr
n K= m de element format la electroliză, g/ K
►3,61/108/ 96500=X/17,33/96500
R: 0,58 g Cr
Problema 4. Prin două celule de electroliză cu electrozi inerți, legate în serie, una conținând o soluție de AgNO3, iar cealaltă o soluție de CuSO4, se trece timp de 6 ore un curent I=2,334 A. Calculează masele metalelor, care se obțin.
Ce trebuie să facem?
– să înțelegem, că dacă, două celule de electroliză sunt legate în serie, prin ele trece un curent electric de aceeași intensitate, I.
☺Deci, cantitatea de curent, Q consumată la electroliza celor două soluții este egală, fiindcă au intensitatea de curent, I, egală cu 2,334A, și timpul egal de 6 ore.
-legea I a electrolizei, care ne permite să calculăm masa de Ag depusă la I=2,334A și timp=6ore.
m Ag depus= K Ag. Q, unde:
Q=cantitatea de electricitate consumată=I.t
I=intensitatea curent electric
t=timp de electroliză (s)
K=echivalent electrochimic Ag= A Ag/z. 96500C
-legea a II-a a electrolizei, cere ne permite să calculăm masa de Cu depus.
m Ag/K Ag= m Cu/K Cu
Calcule
1)Masa de Ag depus=?
A Ag=108g/mol atom
Ag+ + 1 e– = Ag0, n=1
K=108 Eg /96500 C/Eg
t secunde= 6 ore .3600 s
►m Ag= 108.(2,334.6.3600) /96500=56,42 g Ag
2) Masa de Cu depus, m Cu=?
A Cu=64 g/mol .atom
Cu2+ + 2e– = Cu0, z=2 e–
K Cu =A Cu/z.96500= 64/2.96500=32/96500
►56,42 g Ag/ (108: 96500)=m Cu/ (32:96500)
56,42 g/108=m Cu/32
m Cu=56,42.32/108=16,71 g
R: 56,42 g Ag, 16,71 g Cu.
Problema 5. 50 g de CuSO4.5H2O se dizolvă în 500 g de apă. Soluția obținută se supune electrolizei, până la consumarea totală a CuSO4. Se cer:
-
-
-
-
-
-
- Concentrația procentuală a soluției de CuSO4;
- Scrie ecuațiile reacțiilor chimice ce au loc la electroliză;
- Cantitatea de Cu depusă la catod;
- Cantitatea de electricitate consumată.
-
-
-
-
-
Ce trebuie să știm?
–noțiuni de preparare soluții procentuale din cristalohidrați, unde concentrația procentuală se referă la masa de substanță anhidră dizolvată, în soluție. În cazul nostru, se referă la masa de CuSO4 dizolvat, pe care trebuie să-l calculăm din 50 g de CuSO4.5H2O
C% CuSO4= md CuSO4.100/ ms
ms=masa soluției= m CuSO4.5H2O+m apă solvent
SAU
ms= mCuSO4+ mapă din 50 g cristalohidrat + m apă solvent
Nu știm md și ms!
-electroliza soluției apoase de CuSO4.
-legea I a electrolizei:
m Cu depus la catod=K. Q
Unde:
m Cu depus= masa de Cu din CuSO4, fiindcă se dă indicația, că toată cantitatea de Cu adus de sare se depune. Nu sunt pierderi.
K=echivalentul electrochimic al Cu;
Q= cantitatea de electricitate consumată (C)
☺ Deci, trebuie să rezolvăm pe rând cerințele cu explicațiile de mai sus.
Rezolvare
1) Concentrația procentuală a soluției în CuSO4=?
C%=md.100/ms
Pe rând, calculăm:
►md CuSO4 este masa de CuSO4 din 50 g de cristalohidrat, calculat cu regula de trei simplă, dintre masa moleculară și masa de substanță:
M CuSO4..5H2O= MCuSO4+5MH2O=160+90=250 g/mol
Deci:
Dacă în 250 g/mol CuSO4.5H2O…………….sunt…..160 g/mol CuSO4
Atunci în 50g CuSO4.5H2O……………………sunt……md
md=50g.160g/mol/250g/mol=32 g CuSO4
► ms= 50 g cristalohidrat + 500 g apă =550 g soluție
►C%=32 g CuSO4.100/550 g =5,82%
2)Ecuațiile reacțiilor chimice la electroliza soluției apoase de CuSO4 cu electrozi inerți sunt:
-disocierea electrochimică în prezența apei:
CuSO4 aq = Cu2+ + SO42-
2H2O = H3O+ + HO–
-migrarea spre electrozi a ionilor:
La Anod, A(+): ionii HO–, SO42-
La catod, C(-): ionii: Cu2+, H3O+
-reacții redox de descărcarea ionilor de sarcina electrică la electrozi, într-o anumită ordine impusă de potențialul lor de redox și de tensiunea curentului electric. Prima dată se descarcă ionii care cedează sau acceptă cel mai ușor electroni.
A(+) HO– -1 e– = HO. Oxidare
Ag. red 1 Ag ox.1
2.HO. = H2O + ½ O2↑
C(-) Cu2+ + 2 e– (de la HO–) = Cu0 metal↓
-reacția dintre ionii de H3O+ și SO42- rămași în soluție:
2H3O+ + SO42- = H2SO4 + 2H2O
►Reacția globală la electroliză este:
CuSO4 + H2O electroliză→ Cu↓ + ½ O2↑ + H2SO4
3)masa de Cu depus la catod, X, se calculează astfel:
Dacă 160 g de CuSO4………………au 64 g de Cu
Atunci 32 g de CuSO4……………..au X
X=32.64/160=12,8 g Cu
m Cu depus=12,8 g
4) Cantitatea de electricitate consumată:
Q=m/K= m/Acu/z. F
Q=12,8 /(64:2).96500=12,8.96500/32=38600 C.
R: a) 5,82%; c) 12,8 g; d) 38600 C.
Problema 6. 8 g alamă se dizolvă total în H2SO4 concentrat, la cald. Soluția se supune electrolizei. Pentru depunerea întregii cantități de cupru se consumă 4825 C. Calculează compoziția procentuală a alamei, în procente masice.
Ce trebuie să știm?
♣Alama este un aliaj din Cu și Zn în diferite proporții;
-reacțiile H2SO4 concentrat cu Zn și Cu, la cald sunt:
2H2S6+O4 + Zn0 → Zn2+ SO4 + S4+O2↑ + H2O
2H2S6+O4 + Cu0 → Cu2+SO4 + S4+O2 ↑ + H2O
♣la electroliză, ionul de Cu(2+) suferă reacție de reducere și trece în Cu metalic, care se depune pe catod:
Cu2+ + 2e– = Cu0 reducere
Ag.ox1 Ag red1
♣legea I a electrolizei, unde:
m Cu depus la electrod= K. Q, unde :
K=A Cu/z.96500, A Cu =64 g/mol atom, z=2 e– primiți
Q= I.t
☺Precizarea este, că tot Cu din alamă se depune pe electrod.
♣ cum se calculează compoziția procentuală de masă și raportul de masă a unui amestec.
Rezolvare:
☺Calculăm prima dată masa de cupru depus la electrod, apoi, prin diferență calculăm masa de Zn din alamă și în final calculăm compoziția procentuală de masă, adică % de Cu și %de Zn din alamă.
a) Calculăm m Cu =? Aplicăm relația:
m Cu = K. Q
K= 64/2.96500=32/96.500
m = 32.4825 /96500=1,6 g Cu
b) Calculăm masa de Zn din 8 g alamă:
m alamă= m Cu + m Zn;
m Zn=m alamă-m Cu
m Zn= 8 g-1,6 g=6,4 g Zn
c) Calculăm compoziția procentuală de Cu și Zn din 8 g alamă:
% Cu din alamă= m Cu. 100%/m alamă
% Cu din alamă=1,6g.100%/8 g =20%
%Zn din alamă=6,4g.100%/ 8g=80%
Sau:
%Zn = 100%-20% Cu=80%
R: 20% Cu, 80% Zn.
Problema 7 Din greșeală, un recipient care conține FeSO4 a fost lăsat deschis. Pentru a stabili conținutul de FeSO4 se cântărește o probă de 1 g care se aduce în soluție, în mediu acid. Pentru oxidarea întregii cantități de Fe2+, se consumă 10 mL soluție de KMnO4 0,1M. Calculează conținutul procentual, în procente masice, de FeSO4 din recipient.
Ce trebuie să știm?
–între FeSO4 și KMnO4, în mediu acid de H2SO4 are loc o reacție chimică redox:
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4+ K2SO4 + 5Fe2(SO4)3 + 8H2O
Mn7+ + 5e– → Mn2+ reducere / .2
Ag.ox1 Ag red.1
Fe2+ – 1 e– → Fe3+ oxidare /.5
Ag.red2 Ag.ox2
–Permanganometria, este o metodă de analiză volumetrică(titrimetrică), în care titrantul este soluția de KMnO4 în mediu puternic acid, când ionul MnO4– acceptă 5 e– și trece în ionul Mn2+. Titrarea cu soluția de KMnO4 se folosește în practica de laborator pentru analiza cantitativă a substanțelor care au caracter reducător.
-legea echivalenților chimici aplicată la analiza volumetrică:
nEg titrant = nEg substanță analizată, unde:
nEg =număr de Echivalenți gram, care se calculează din expresia matematică a concentrației normale:
–calcul stoechiometric al cantității de FeSO4 pur, consumat de o cantitate de KMnO4 adus de soluție
☺Deci, calculăm prima dată numărul de moli de KMnO4 din 10 mL soluție 0,1M, care consumă un număr de moli de FeSO4 și apoi masa acestora (g), în final calculăm conținutul procentual de FeSO4 din 1 g de probă.
Calcule:
a) Calculăm n moli KMnO4 din 10 mL soluție 0,1 M =? , la care concentrația molară, CM=0,1M și volum soluție, Vs, este 10mL
CM =n moli KMnO4 dizolvat/Vs
n moli KMnO4 = 0,1 mol/L.10.10-3 L=10-3 mol
b)Calculăm n moli FeSO4 consumat, X, de 10-3 moli KMnO4, cu un calcul stoechiometric la ecuația reacției chimice:
10-3moliKMnO4…..X
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4+ K2SO4 + 5Fe2(SO4)3 + 8H2O
2moli KMnO4…10 moli FeSO4
X = 10-3.10 /2= 5.10-3 moli FeSO4
c) Masa de FeSO4, g, pe care o au 5.10-3 moli de KMnO4 se calculează astfel:
m FeSO4 = n moli FeSO4. M FeSO4
m FeSO4=5.10-3.152=0,76 g
d) Conținutul procentual de FeSO4 este:
% FeSO4 = 0,76.100%/1 g =76 %
R: 76% Fe
PROBLEME SIMPLE DESPRE CĂLDURA DE DIZOLVARE A SUBSTANȚELOR
Căldura de dizolvare este căldura degajată sau absorbită la dizolvarea unui mol de solut într-o cantitate dată de solvent( un număr de moli de apă), pentru obținerea unei soluții de concentrație prestabilită.
La presiune constantă, căldura molară de dizolvare se numește entalpie molară de dizolvare,
∆ H dizolvare, cu unitatea de măsură:(kJ/mol, kcal/mol). Se măsoară o variație a cantității de energie a sistemului prin căldura schimbată cu mediul exterior la presiune constantă.
Convenția de semn pentru variația de entalpie molară de dizolvare și căldura de dizolvare(Q) este:
Q/n moli solut = -∆H (kJ)
Căldura de dizolvare se măsoară cu ajutorul calorimetrului.
Relația matematică pentru calcularea căldurii de dizolvare este:
Q=m.c.∆t
Unde:
Q=cantitatea de căldură degajată (kJ)
M=masa soluției din calorimetru (g)
C=capacitatea calorică a sistemului format din calorimetru și din soluția de NaOH. (J/g.grad)
C=cs(capacitatea calorică a soluției)+cc (capacitatea calorică a calorimetrului)
∆t=variația de temperatură, în timpul dizolvării. Este diferența de temperatură dintre temperatura finală(tf) și temperatura inițială(ti).
Tabel 1, Călduri de dizolvare, kcal/mol de solut, în apă la 25 0C
|
|
|
| HCl | 200 | -17,74 |
| CuSO4 | 800 | -16,43 |
| CuSO4 . 5H2O | 795 | +2,42 |
| NH4NO3 | 200 | +6,08 |
Din aceste exemple, deducem că sărurile hidratate și sărurile, care nu formează hidrați stabili au călduri de dizolvare pozitive, adică consumă căldură din dizolvare. Acizii care se combină cu apa, bazele și sărurile anhidre, care formează hidrați au călduri de dizolvare negative, adică se degajă căldură la dizolvare.
Procesul de dizolvare este influențat de următoarele interacțiuni:
-ruperea legăturilor chimice dintre particulele substanței dizolvate, care are loc cu absorbție de căldură, ∆H1, proces endoterm
– ruperea legăturilor chimice dintre particulele solventului, care are loc cu absorbție de căldură, ∆H2, proces endoterm
-interacțiuni între particulele de solvat-solvent, care are loc cu degajare de căldură, ∆H3, proces exoterm . Formarea de legături slabe între moleculele solvatului și ale solutului se numește solvatare. Dacă solventul este apa, se numește hidratare.
Rezultă:
Căldura de dizolvare ∆H este suma:
∆H = ∆H1+∆H2+∆H3
Dizolvarea este în concluzie, un proces care are loc, din cauza formării de legături slabe între moleculele de solut și moleculele de solvent.
Exercițiul 1 Cuvinte cheie: căldura de dizolvare la KOH, Dizolvare exotermă
Într-un calorimetru ce conține 50 g de apă distilată la temperatura de 20 0C se adaugă 2,8 g de KOH și se obține o soluție de o anumită concentrație procentuală. Temperatura crește la 23 0C. a)Calculați căldura molară de dizolvare a KOH (∆H (kJ/mol). Căldura specifică a soluției este 1 cal/g.grad (4,184 J/g.grad). Se neglijează capacitatea calorică a calorimetrului. b) Concentrația procentuală a soluției de KOH din calorimetru.
Rezolvare
Ce trebuie să știm?
Relațiile matematice, pentru calcularea căldurii degajate la dizolvare, respectiv pentru calcularea entalpiei molare de dizolvare a KOH sunt:
►Cantitatea de căldură Q, se calculează cu relația matematică:
Q=m. c. ∆t
m=masa soluției (g)
c soluție=căldura specifică a soluției; 1 cal/g.grad =4,18 J/g.grad
∆t= variația de temperatură =t final-t inițial
► Entalpia molară de dizolvare ∆H dizolvare KOH se calculează cu relația:
∆H dizolvare KOH= –Q/ n moli KOH (J/mol)
Fig.1 Dizolvarea exotermă a KOH în apă
Necunoscutele în această problemă sunt:
- -masa soluției de KOH din calorimetru
- -n moli KOH
- -Q soluție (Q calorimetru)
- -∆H dizolvare KOH
- -concentrația procentuală de masă a soluției de KOH din calorimetru (c%)
Calcule
1.Masa soluției de KOH din calorimetru (ms)=?
ms= m apă +m KOH=50g+2,8 g de KOH=52,8 g soluție KOH
- Numărul de moli de KOH=?
n moli = masa KOH (g)/ M KOH g/mol
n moli = 2,8g/56 g/mol=0,05 moli
- Q soluție=m soluție. c soluție. ∆t
Q soluție=52,8 g.4,184 J/g.grad.(23-20) grade C=662,75 J
- ∆H-= – Q/n moli
∆H=- 662,75 J/0,05moli=13254, 9J/mol=1,325 kJ/mol
- C% = md KOH.100/ms = 2,8g.100%/ 52,8 g=5,30%
R: 1,325 kJ/mol, 5,30%
Exercițiul 2 Cuvinte cheie: căldura de dizolvare a glucozei, dizolvare endotermă.
a)Să se calculeze efectul termic (căldura de dizolvare, kcal)) produs prin dizolvarea la 15 0C, a 1,8 g de glucoză (C6H12O6) în apă, știind că se obține o soluție cu concentrația de 9,10%.b) să se calculeze temperatura finală a soluției rezultate, dacă căldura ei specifică este 1 cal/g.grad. Se neglijează căldura specifică a calorimetrului.
Rezolvare
Ce trebuie să știm?
Relația matematică dintre căldura de dizolvare (Q) și căldura molară de dizolvare (∆H diz, kcal/mol) a unui mol de C6H12O6 :
Q=-n. ∆H diz = m soluție (g). căldura specifică soluție (cal/g.grad). ∆t (grade C)
∆t= t final-inițial
Date cunoscute și necunoscute:
-Substanța dizolvată=glucoza; masa dizolvată de glucoză=1,8 g
-Solvent=apa; masa apă =?=X (g)
-Soluția formată=soluție de glucoză →concentrație procentuală=9,10% C6H12O6
→procentul de apă din soluție=100%-9,10% C6H12O6
→masa soluției=?=Y (g)
-Masa soluției (g)= md C6H12O6 + m apă
-Concentrația procentuală a soluției de glucoză este:
-C%= md C6H12O6.100%/ m soluție
-Căldura molară de dizolvare la glucoză se ia din tabele și este:
-∆H dizolvare C6H12O6 pentru raportul molar: 1mol glucoză la 100 moli apă, la 15 grade C=+2,25 kcal/mol, dizolvarea glucozei este endotermă.
-Temperatura inițială, este temperatura apei (t in)=15 0C
-Temperatura finală, după terminarea procesului de dizolvare a glucozei=tf=?
-Căldura specifică a soluției de glucoză de 9,10%=1 cal/g.grad
-Masa moleculară C6H12O6=180 g/mol
-Masa moleculară la H2O=1 cal/g.grad
-Cantitatea de căldură absorbită din mediul exterior la dizolvarea C6H12O6=Q=?
Etape de calcul ◊◊◊
♠1)Verificăm dacă în soluția cu 1,8 g de C6H12O6 și concentrația procentuală 9,10% de C6H12O6, există raportul molar 1 mol C6H12O6:100 moli H2O →♠ 2) Dacă da, utilizăm ∆H dizolvare =+2,25 kcal/mol pentru a calcula Q →♠ 3) din relația de calcul Q, cunoscând m soluție, c soluție, t in, vom calculăm t fin (grade C).
Calcule:
1.Raportul molar din soluția dată de glucoză:
Dacă 9,10% C6H12O6…………….corespunde ………….la… 90,9 % H2O
Atunci 1,8 g C6H12O6…………….corespund…………..la X(g) H2O
X=1,8g.90,9%/9,10%=17,98 g H2O aprox.18 g
N moli C6H12O6 = 1,8 g/180 g/mol=0,01 moli
N moli H2O = 17,98 g/18 g/mol=aprox.1 mol
Raportul molar: moli C6H12O6 : moli H2O= 0,01: 1/ : 0,01
Rezultă: 1:100. Putem folosi valoarea căldurii molare de dizolvare din tabel, +2,25 kcal/mol
2.Calculăm căldura de dizolvare Q a glucozei cu relația:
Q=- n moli C6H12O6. ∆H dizolvare
Q=-(0,01 moli.(+2,25 kcal/mol)= -0,0225 kcal
3.Calculăm temperatura finală, t fin, din relația:
Q= m soluție. c soluție .∆t, ∆t=t fin-t in
m soluție =Y=1,8 g de C6H12O6 + 18 g de H2O=19,8 g soluție
Rezultă:
Q=-0,0225.1000 cal=19,8 g .1 cal/g.grad .∆t
∆t=-22,5 grad / 19,8=-1,136, aprox.-1,14 grade C
∆t=-1,14 grade C=t fin-15 grade C
t fin = 15 grade C-1,14 grade C=13,86 grade C
R: Q=-22,5 cal; t fin=13,86 grade C.
PROBLEME DE LA CONCURSURI NATIONALE
Sunt rezolvãri ale unor probleme de chimie, date la titularizare şi bacalaureat şi care se adreseazã celor interesaţi. Varianta de rezolvare este punctul meu de vedere şi nu anuleazã metodele dobândite de ei. Este doar dorinţa de a ajuta – dacã m-ar întreba cineva:”- De ce faci aceasta?”
Când cineva din familie trece prin aceste concursuri, înţelegi ce se întâmplã.
- Sper sã ajute.
https://chimieanorganica.wordpress.com/probleme-de-la-concursurile-nationale/
CALCULE STOECHIOMETRICE CU ECUAȚII CHIMICE REDOX
Bibliografie:
Reactii redox, problema 29
Daniela Bogdan, Probleme de chimie, Culegere pentru clasa a IX-a, Editura Mistral Info media
***
Peste 23,14 g aliaj Au-Cu se adaugă 59 mL soluție HNO3, 63% (ρ=1,39 g/mL) și 5 mL soluție HCl 36,5% (ρ=1,2 g/mL). Determinați:
a) compoziția procentuală a aliajului (cu 2 zecimale); b)dacă, acizii se consumă total.
Etape de calcul
► identificăm:
– avem amestecul de acizi HNO3 și HCl, care poate fi în proporția de: 3moli HCl: 1mol HNO3
– metalul Au reacționează cu apa regală, se dizolvă în aceasta cu formare de AuCl3
-metalul Cu reacționează cu acizii oxidanți, deci va reacționa cu HNO3
►scriem cele două reacții chimice redox, ce au loc între metalele Au și Cu și acizii HNO3 și HCl:
r1) reacția dintre Au cu apa regală ( 3 parti HCl și o parte HNO3
Au (s) + (3HCl(aq) + HNO3(aq))→ AuCl3 (aq)+ NO(g)↑ + 2 H2O (l)
Au0 – 3 e– → Au3+ reacție de oxidare ;
Au metal este agent reducător
N5+ + 3 e– → N2+ reacție de reducere;
HNO3 , care conține N5+ este agent oxidant
r2)*** reactia Cu cu HNO3
3Cu(s) + 8HNO3 (aq) → 3Cu(NO3)2 (aq) + 2NO (g)↑ + 4H2O(l)
NO + 1/2 O2 = NO2
Cu0 – 2 e–→ Cu2+ reacție de oxidare
Cu0 este agent reducător
N5+ + 3 e– → N2+ reacție de reducere
HNO3, care conține N5+ este agent oxidant
a) Calcule pentru determinarea compoziției procentuale a aliajului Au-Cu
►calculăm masa de HCl dizolvat în 5 mL soluție de concentrație procentuală 36,5% și densitate de 1,2 g/mL:
C% HCl= md HCl .100 / ms
*md HCl = C% .ms/100 %
ρ soluție HCl = ms / Vs
*ms= Vs. ρ s
Rezultă:
md HCl =C% HCl . Vs HCl .ρs HCl / 100%
md HCl = 36,5%. 5mL . 1,2g. mL-1 / 100% =2,19 g HCl
►calculăm masa de HNO3 dizolvat în 59 mL soluție de concentrație procentuală 63% și densitatea de 1,39 g/mL, cu expresia matematică:
md HNO3 = C% HNO3.Vs HNO3 . ρs HNO3 / 100%
md HNO3 =63%.59 mL . 1,39 g.mL-1 / 100% = 51,66 g HNO3
► calculăm masa de Au (x, g) consumată stoechiometric de 2,19 g de HCl, cu ecuația chimică (r1). Cantitatea de HCl este mai mică decât cantitatea de HNO3 și se vor începe calculele cu aceasta ( 2,19 g HCl).
A Au=197 (g / mol atom)
M HCl= 36,5 g/mol
x (g)………….2,19 g
Au (s) + (3HCl(aq) + HNO3(aq))→ AuCl3 (aq)+ NO(g)↑ 2 H2O (l)
197…………3.36,5
x (g) Au = 197.2,19 g/ 3.36,5= 3,94 g Au
► calculăm masa de Cu din 23,14 g de aliaj Au-Cu
m aliaj = m Au + m Cu
m Cu= m aliaj-m Au=23,14–3,94=19,2 g
►calculăm compoziția procentuală a aliajului:
% Au = m Au.100%/m aliaj = 3,94g.100%/ 23,14g=17,03%
% Cu=m Cu.100%/ m aliaj=(100%-%Au)=19,2 g.100%/ 23,14g=82,97 %
R: 17,03% Au; 82,97% Cu
b) Calcule pentru determinarea, dacă 51,66 g de HNO3 se consumă total.
► calculăm masa de HNO3 existentă în apa regală, cu 2,19 g de HCl:
M HNO3 = 63g/mol; M HCl=36,5 g/mol
1mol HNO3.63 g/mol……….corespunde la 3 mol HCl . 36,5 g/mol
y, g, HNO3………………………corespund la 2,19 g HCl
y, g, HNO3= 63g .2,19g/ 3.36,5 g=1,26 g HNO3
► calculăm masa de HNO3 (z), consumată stoechiometric de 19,2 g de Cu, în reacția chimică r2:
A Cu= 64 g/mol
19,2 g……….z,g HNO3
3Cu(s) + 8HNO3 (aq) → 3Cu(NO3)2 (aq) + 2NO (g)↑ + 4H2O(l)
3.64 ………..8.63
z (g) HNO3 = 19,2 g. 8.63/3.64=50,40 g
► verificăm, dacă suma dintre cantitățile de HNO3, calculate mai sus – y și z, este egală cu 51,66 g HNO3 introdus în reacție.
y + z = 1,26 g HNO3+50,40g HNO3=51,66 g
Suma este egală cu 51,66 g de HNO3 introdus inițial, deci HNO3 se consumă total.

R: HCl și HNO3 se consumă total.
TITRUL ÎN RAPORT CU SUBSTANȚA DE DETERMINAT
Este un punct de vedere personal. Nu contrazic alte variante de rezolvare.
NOȚIUNI
►NOTAȚII
- B=soluția reactiv, de concentrație cunoscută, numită și soluție titrată, titrant
- A=substanța de analizat, pură
►Ecuația chimică generală,dintre titrant și substanța de analizat este:
B (titrant) + A (substanța de analizat, dozat)=C (produși de reacție)
►Conceptul de TITRU ÎN RAPORT CU SUBSTANȚA DE ANALIZAT, A UNEI SUBSTANȚE REACTIV FOLOSITĂ LA TITRARE
- notare: T B/ A,(g/mL);unde linia / semnifică:raportat,în raport cu ceva, cineva
- definim titrul soluției titrant B, în raport cu substanța de analizat,A, ”T B/A”, numărul care arată cantitatea din substanța de analizat, A, exprimată în grame, echivalentă cu cantitatea de titrant B, care se află în 1 mL soluție de titrant, B.
(adică: numărul de echivalenți gram de B din 1 mL soluție B= numărul de echivalenți gram de A)
► Relația matematică pentru calcularea lui T B/ A,când se cunoaște T B
T B/A=(T B (g/mL). Eg A)/Eg B
Eg B=echivalent gram al titrantului B
Eg A=echivalent gram al substanței de analizat
Eg B și E g A se calculează cu regulile învățate, când substanța participă la reacții de neutralizare și redox.
-
EXERCIȚII REZOLVATE PENTRU PATRU TIPURI DE REACȚII CHIMICE
-
ÎNTÂLNITE ÎN ANALIZA VOLUMETRICĂ
TIPURI DE REACȚII CHIMICE ÎN ANALIZA VOLUMETRICĂ
Reacția de neutralizare
Reacția de oxido-reducere (redox)
Reacția de precipitare
Reacția de complexare
DEMONSTRAREA RELAȚIEI MATEMATICE PENTRU CALCULAREA LUI T B/A
O soluție de NaOH are titrul egal cu 0,043522 g/mL. Să se calculeze titrul acestei soluții în raport cu HCl, T NaOH/ HCl. .
Rezolvare
Notăm:
HCl=substanța de analizat,A
NaOH = titrant,B
T B/A=T NaOH/HCl=titrul soluției de NaOH în raport cu HCl
Știm:
►Titrul soluției de NaOH=T NaOH=0,043522 g/mL
►între NaOH și HCl are loc o reacție de neutralizare:
NaOH+HCl=NaCl+H2O
►Cum se aplică conceptul de ”T B/ A,(g/mL)” la problema de față?
-Prima dată, trebuie să calculăm câți Echivalenți gram de HCl corespund la numărul de Eg de NaOH din 1 mL soluție de NaOH cu titrul de 0,043522(g/mL)!
nEg NaOH din 1 mL soluție = nEg HCl
–Apoi, vom calcula cantitatea de HCl (g) din 1 mL, din numărul de echivalenți gram de HCl!
Această cantitate de HCl g/mL este T NaOH/HCl
►Ce este echivalentul gram?
Eg NaOH=echivalentul gram NaOH
Eg NaOH=Masa moleculară NaOH/număr de grupări OH
Eg NaOH=M NaOH(g/mol)/1=M NaOH=40
Eg HCl=echivalentul gram HCl
Eg HCl=Masa moleculară HCl/număr de protoni cedați H (+)
Eg HCl=M HCl/1=M HCl=36,5
Nu știm și trebuie să calculăm:
-cantitatea de NaOH (g) din 1 mL soluție=m NaOH=?,g
-nEg NaOH=?
-nEg HCl=?
-cantitatea de HCl echivalentă=? g/mL
-T HCl/NaOH=?(g/mL)
Calcule. Etape:
►m NaOH o calculăm din titrul, T NaOH (g/mL), cu definiția lui
Potrivit definiției titrului:
1mL soluție NaOH are 0,043522 g NaOH dizolvat.
►n Eg NaOH=m NaOH/M NaOH
n Eg NaOH=0,043522 g/ 40(g/mol)=0,0010881/1 mL soluție de NaOH
►nEg HCl este egal cu nEg NaOH/1mL
Rezultă că:nEg HCl=0,0010881
►m HCl/1mL=?
m HCl=nEg HCl.Eg HCl
m HCl=0,0010881.36,5=0,039713 g
Formula de calcul ♠
T B/A=(T B (g/mL). Eg A)/Eg B
T NaOH/HCl/=(0,043522 g/mL.36,5)/40=0,039713 g/mL
TIP REACȚIA DE NEUTRALIZARE
Titrul unei soluții de Na2B4O7. 10 H2O este 0,019069 g/mL. Să se calculeze titrul acestei soluții în raport cu HCl, T Na2B4O7. 10 H2O/HCl.
****
În analiza volumetrică bazată pe reacții de neutralizare, boraxul (Na2B4O7. 10 H2O) este o substanță etalon, care formează soluții de concentrație exactă, numite și etalon.
Factorul soluției de HCl, de concentrație aproximativă 0,1 N, se determină prin titrare cu soluția 0,1 N de Na2B4O7. 10 H2O, în prezența indicatorului acido-bazic metiloranj sau roșu de metil.
Rezolvare
Notăm astfel:
HCl=substanța de analizat,A
Na2B4O7. 10 H2O=titrant,B
T B/A=T Na2B4O7. 10 H2O/HCl=titrul soluției de Na2B4O7. 10 H2O în raport cu HCl
Știm:
►Titrul soluției de Na2B4O7. 10 H2O=T Na2B4O7. 10 H2O=0,019069 g/mL
►Reacțiile chimice din timpul titrării sunt:
a)reacția de hidroliza bazică a Na2B4O7 în soluție apoasă:
Na2B4O7 + 7 H2O ↔ 2 NaOH + 4 H3BO3
1mol de Na2B4O7 produce 2 moli de NaOH, bază tare.
H3BO3 este un acid slab, la care Ka este 6,0.10-10 și nu va influența semnificativ rezultatele titrării.
b)reacția de neutralizare dintre cei 2 moli de NaOH formați cu HCl, existent în paharul Erlenmayer:
2NaOH+2HCl→2NaCl+2H2O
⇒ Reacția globală din timpul titrării este:
Na2B4O7 + 2 HCl + 5 H2O→ 2NaCl + 4 H3BO3
►Punctul de echivalență este dat de virajul culorii indicatorului acido-bazic, metiloranj, în acest caz.
► La punctul de echivalență:
număr Eg de Na2B4O7 =număr de Eg de H3BO3
Eg=echivalent gram
Eg la Na2B4O7=190,686
Eg la HCl=36,458
Calcul T Na2B4O7/HCl cu expresia matematică
T B/A=(T B(g/mL).Eg A )/Eg B
T Na2B4O7 / HCl =0,019069 g/mL.36,458/190,686=0,003646 g/mL aprox
R: T Na2B4O7 / HCl =0,003646 g/mL
TIP REACȚIA DE PRECIPITARE
Câte grame de clor se găsesc într-o soluție de NaCl, dacă la titrarea s-au consumat 19,95 mL soluție de AgNO3, , la care titrul T AgNO3/Cl=0,03640 g/mL. Dozarea clorurii de sodiu are loc cu metoda MOHR, indicator al punctului de echivalență este cromatul de potasiu,soluție.
Rezolvare
Notăm astfel:
-ionul de Cl(-),din NaCl=ionul de analizat,A
-masa de Cl(-)=?(g) X (g)
AgNO3,=titrant,B
T B/A= T AgNO3, /Cl(-)=titrul soluției de AgNO3, în raport cu ionul de Cl(-)
Știm:
► T AgNO3, /Cl=0,03640 g/mL
► Volumul soluției de AgNO3, =Vs AgNO3, =19,95 mL
►Metoda Mohr se bazează pe următoarele reacții chimice:
-reacția de titrare:
Ag+(reactiv)+Cl–(substanța de analizat) ↔ AgCl↓ alb
-reacția de indicare, pE:
2 Ag+ + CrO42- ↔ Ag2 CrO4 ↓ roșu
Ks AgCl=1,8 .10-10
Ks Ag2CrO4 =8,2.10-12
►Eg AgNO3 =M AgNO3=169,875
►Eg Cl(-) =35,457
Etape de calcul
☺calculăm titrul de Ag(+ ) cu expresia matematică:
T B/A=(T B (g/mL).E g A )/Eg B
T AgNO3/Cl =T AgNO3.Eg Cl (-)/Eg AgNO3
0,03640 g/mL =TAgNO3.35,457/169,875
0,03640 g/mL . 169,875=T AgNO335,457
T AgNO3=6,18345 g/mL/35,457=0,174393 g/mL
☺calculăm masa de AgNO3 grame din 19,95 mL soluție AgNO3
m AgNO3=T AgNO3.Vs de AgNO3=0,174393 g/mL.19,95=3,47913887 g≈3,4791g
☺calculăm masa de Cl(-), X (g), cu legea echivalenților:
nEg AgNO3=nEg Cl(-)
m AgNO3/Eg AAgNO3=X/Eg Cl(-)
3,4791g/169,875=X/35,457
3,4791.35,457=X.169,875
X=0,72617≈0,7262 g de ion Cl(-)
Rezultă că:
R: 0,7262 g de ion Cl(-)
TIP REACȚIA REDOX
Din 0,7120 g cristalohidrat de oxalat de amoniu se prepară într-un balon cotat 200 mL soluție. Pentru titrarea a 25 mL din această soluție sunt necesari 18,90 mL soluție de KMnO4, mediu puternic acid, de H2SO4.Să se calculeze T KMnO4/Fe2+, pentru titrarea în mediu acid.(titrul soluției de KMnO4, în raport cu Fe2+).
Rezolvare
Explicație
a)Avem o soluție de KMnO4, de o anumită concentrație necunoscută, exprimată sub formă de titru (g/mL), care titrează o soluție de C2O4(NH4)2.2H2O, de volum și concentrație cunoscută (sau număr de echivalenți).În timpul titrării are loc reacția chimică redox dintre C2O4(NH4)2.2H2O cu KMnO4 în mediu acid. Indicator al punctului de echivalență este chiar soluția de KMnO4.
Forma ionică a ecuației chimice este compusă din semireacțiile de:
–reducere:
(Mn7+ O4 2-)– + 5 e– +8 H+ → Mn2+ + 4H2O / .2
KMnO4= agent oxidant Mn2+= agent reducător
–oxidare:
(O22- C3+ – C3+ O22- )2- – 2 e– → 2 C4+ O22- / .5
C2O4(NH4)2.2H2O=agent reducător; CO2= agent oxidant
număr de e- cedați=număr de e- acceptați
►2MnO42- + 10e- + 16 H+ + 5C2O42- -10 e– → 2Mn2+ +8 H2O + 10 CO2
Ecuația chimică a reacției chimice este:
***
2KMnO4 +8 H2SO4 + 5C2O4 (NH4)2 → 2MnSO4+K2SO4+5(NH4)2SO4+8 H2O+10 CO2
b) Aceeași, soluție de KMNO4, cu titrul calculat mai sus, titrează o soluție ce conține ionul Fe(2+), în mediu acid. În timpul titrării are loc reacția chimică redox dintre ionul Fe(2+) cu KMnO4 în mediu acid.
Ecuația ionică forma redusă este:
5Fe2+ + Mn5+O42- + 8H+ ↔ Mn2+ + 5 Fe3+ + 4H2O
Fe2+=agent reducător
KMnO4=agent oxidant
Baza calculării T KMnO4/Fe
▼Se aplică relația matematică:
T KMnO4/Fe2+ =T KMnO4.Eg Fe2+ /Eg KMnO4
unde:
♠T KMnO4=titrul soluției de KMnO4 (g/mL),care reacționează cu C2O4(NH4)2.2H2O, adus de 25 mL soluție, extrasă din balonul cotat, unde s-au dizolvat 0,7120 g de C2O4(NH4)2.2H2O.
♠Eg Fe2+ =echivalentul gram al ionului Fe2+ în reacția chimică redox cu KMnO4
♠Eg KMnO4=echivalentul gram al KMnO4, în reacția chimică redox cu Fe2+ și C2O4(NH4)2.2H2O, în mediu acid
▼
T KMnO4 se calculează cu ajutorul legii echivalenților pentru reacția chimică cu C2O4(NH4)2.2H2O, și a relației matematice pentru Titru:
n Eg KMnO4=nEg C2O4(NH4)2.2H2O
T =md KMnO4(g)/Vs(mL)
unde:
nEg KMnO4=număr de Eg de KMnO4
nEg C2O4(NH4)2.2H2O=număr de Eg de C2O4(NH4)2.2H2O
Etape de calcul
♫ Notăm cu:
X=masa de C2O4(NH4)2.2H2O din 25 mL soluție, care se va titra
Y=masa de KMnO4 consumat în reacție de,X, g de C2O4(NH4)2.2H2O
► calculăm masa de C2O4(NH4)2.2H2O, X, din 25 mL soluție, dacă în 200 mL soluție se dizolvă 0,7120 g de C2O4(NH4)2.2H2O , cu regula de trei simplă.
dacă în 200 mL soluție………….sunt…….. 0,7120 g de C2O4(NH4)2.2H2O dizolvat
atunci în 25 mL soluție…………….sunt……….X, g,
X=25 mL.0,7120 g/200 mL=0,7120/4=0,1780 g de C2O4(NH4)2.2H2O
►calculăm masa de KMnO4,Y, consumat în reacția redox de 0,1780 g de C2O4(NH4)2.2H2O, cu legea echivalenților:
n Eg KMnO4=nEgC2O4(NH4)2.2H2O
unde:
nEg de KMnO4=masa de KMnO4/E KMnO4 pentru reacția redox
Eg KMnO4=M KMnO4 /număr de e- acceptați=158 g/mol /5=31,6
►n Eg KMnO4=X/31,6
***
nEg de C2O4(NH4)2.2H2O=masa C2O4(NH4)2.2H2O/Eg C2O4(NH4)2.2H2O
masa de C2O4(NH4)2.2H2O=0,1780 g
Eg C2O4(NH4)2.2H2O=M C2O4(NH4)2.2H2O/ 2.1 e- cedați
M C2O4(NH4)2.2H2O=2.A C+4.AO+2.A N+8.A H+2.M H2O=142 g/mol
Eg C2O4(NH4)2.2H2O=142/2=71
2=număr de C(3+),care cedează fiecare câte 1 e-
►n Eg C2O4(NH4)2.2H2O =0,1780 /71
Rezultă din legea echivalenților:
X/31,6=0,1780/71
X=31,6.1,253.10-3
m KMnO4=X=31,6.1,253.10-3 g
►calculăm T KMnO4:
T KMnO4=md KMnO4/Vs KMnO4=31,6.1,253.10-3 g/18,9mL
= 31,6.0,06629.10-3 (g/mL)
►calculăm T KMnO4/Fe2+ cu expresia matematică:
T KMnO4/Fe2+ =T KMnO4.Eg Fe2+ /Eg KMnO4
Eg Fe2+ =A Fe2+ /număr de electroni cedați
Eg Fe2+ =56/1=56
T KMnO4/Fe2+ =31,6.0,06629.10-3 (g/mL).56/31,6=3,712592.10-3
►T KMnO4/Fe2+ =0,0037126
R:0,0037126
TIP REACȚIA DE COMPLEXARE
Determinarea halogenurilor solubile cu Hg(NO3)2 – Mercurimetria
Mercurimetria include metode titrimetrice, bazate pe formarea unor combinații complexe dintre (Hg(NO3)2 titrant și ionii de analizat, precum Cl-, Br-, I-, SCN-.
Un indicator al punctului de echivalență poate fi difenilcarbazona (pH =3,2-3,3), împreună cu bromofenol, pentru a regla pH-ul și care cu Hg2+. Se formează un complex, de culoare violet. Se lucrează la pH acid (adăugare de HNO3), pentru evitarea hidrolizei Hg2+.
Factorul de corecție al concentrației soluției de Hg(NO3)2 se stabilește prin titrare cu o soluție titrofixă de NaCl.
DOZAREA IODURII DE POTASIU PRIN TITRARE CU SOLUȚIE DE AZOTAT DE MERCUR
20 mL de soluție ce conține KI se titrează cu 15,5mL soluție de Hg(NO3)2, 0,1 M, cu factorul de corecție pentru concentrație, F=1,0081.a)Scrieți reacțiile chimice, ce au loc în timpul titrării; b)Calculați T KI (g/mL);c) Determinați T Hg(NO3)2 /KI.
Rezolvare
a) Au loc următoarele reacții chimice:
Reacțiile chimice sunt complexe, dar pentru calcule analitice se acceptă următoarele.
momentul 1:până la pE: exces de KI
În paharul de titrare, există:
-ioni de I– și de K+ neconsumați din soluția de analizat;
-precipitatul HgI2, de culoare roșie, instabil în exces de ioni I(-),fiindcă suferă reacții de complexare;
complexul [HgI4 ]2-. Se admite existența unor complecși inferiori instabili.
Hg(NO3)2 +2KI=HgI2↓+2KNO3
HgI2↓ +2 KI =K2 + [HgI4 ]2-
moment 2: la pE
Ionii de I- s-au consumat și există ionul complex [HgI4 ]2-.
Este valabilă legea echivalenților:
nEg KI=nEg de Hg(NO3)2
moment 3, peste pE; este exces de Hg(NO3)2 .
Dacă se adaugă din biuretă Hg(NO3)2 ,complexul [HgI4 ]2- este descompus, cu formarea precipitatului HgI2:
[HgI4 ]2-+ Hg2+ ↔ 2HgI2 precipitat
Titrarea se oprește la apariția precipitatului HgI2,de culoare roșie.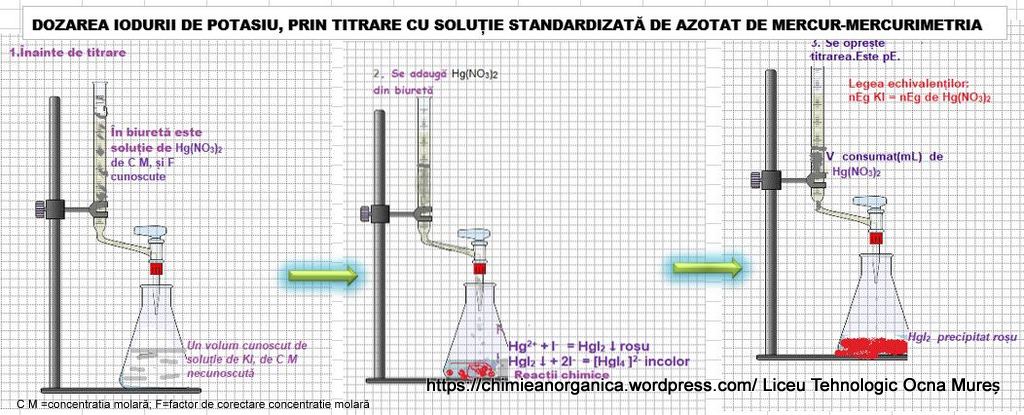
b) Titrul, T al soluției KI,dacă volumul soluției este 20 mL
b1) Explicații
Se aplică relația matematică:
T KI=md KI/Vs (g/mL)
unde:
md KI=masa dizolvată de KI (g) în 20 mL
Vs= volumul soluției de KI=20 mL
► Nu știm md KI și se calculează cu legea echivalenților, la momentul punctului de echivalență, de la titrarea cu Hg(NO3)2:
nEg de KI=nEg de Hg(NO3)2
nEg=număr de echivalenți gram de Ki, respectiv Hg(NO3)2
nEg=md/Eg
Eg KI și respectiv Eg Hg(NO3)2 se calculează cu expresia matematică pentru săruri, când nu participă, la reacții redox:
Eg KI=M KI/număr de K(metal).valența K
Eg Hg(NO3)2 = M Hg(NO3)2 / număr de Hg(metal).valența Hg
………………………………………………………………………………………………
b2) Etape de calcul
►Calcul de md de Hg(NO3)2 (g) din 15,5 mL soluție de concentrație molară 0,1 M și F=1,0081, astfel:
C M=md Hg(NO3)2 /M Hg(NO3)2 .Vs.F (mol/L)
M Hg(NO3)2 =A Hg + 2.AN + 6.A O=201+2.14+6.16=201+28+96=325g/mol
Rezultă:
0,1 mol/L=md/325g/mol.15,5.10exp-3L.1,0081
md Hg(NO3)2 =0,1.325g.15,5.10exp-3.1,0081=0,5078 g
► Calcul Eg de Hg(NO3)2
Eg Hg(NO3)2 =M Hg(NO3)2 /2.1=325/2=162,5 g
► Calcul nEg de KI, din legea echivalenților:
nEg KI=nEg Hg(NO3)2 =0,5078/162,5=3,1249.10exp-3
► Calcul md de KI (g)
md KI=nEg KI.Eg KI
Eg KI=M KI/1.1= M KI=A K+ A I=39+127=166g
Rezultă:
md KI=3,1249.10-exp3 .166=0,5187 g
► Calcul T KI (g/mL)
T KI=0,5187g/20 mL=0,02594 g/mL
R: 0,02594 g/mL
*******************************************
c) Calcul T Hg(NO3)2 /KI
Explicații
c1) Se aplică relația matematică:
T Hg(NO3)2 /KI=T Hg(NO3)2 . Eg KI/Eg Hg(NO3)2
unde:
T Hg(NO3)2 =titrul soluției de Hg(NO3)2 (g/mL)
Eg Hg(NO3)2 =echivalentul gram Hg(NO3)2
Eg KI=echivalentul gram la KI
c2) Se calculează Hg(NO3)2 astfel:
T Hg(NO3)2 =md Hg(NO3)2/Vs (g/mL)
T Hg(NO3)2 =0,5187 g/20 mL=0,025935 aprox 0,0259 g/mL
Rezultă:
T Hg(NO3)2 /KI=0,0259 g/mL.166/162,5 g=0,02646 g/mL
R: 0,02646 g/mL
BIBLIOGRAFIE
1.Conf. Dr. Maria Mitrănescu, Curs de Chimie Analitică cantitativă, Institutul Politehnic ”Traian Vuia”, Timișoara, 1979
2. https://chimieanalytique.com/mercurimetrie/
3.https://images.app.goo.gl/xK2nrCgZFyQpPr5Q6
4. https://www.youtube.com/watch?v=FVmKKqce_Qg
OPERATII DE BAZĂ ÎN LABORATORUL DE CHIMIE ANALITICĂ-FIȘE DE LUCRU
FIȘA DE AUTOEVALUARE DIN ”USTENSILE UZUALE DIN LABORATORUL
DE ANALIZE FIZICO-CHIMICE”
https://www.liveworksheets.com/ng1195230ti
Vă prezint acest instrument de autoevaluare, care vă ajută să identificați ustensilele din cadrul analizelor chimice calitative și cantitative, respectiv din cadrul analizelor instrumentale.
Am folosit programa școlară, pentru calificarea Tehnician în Chimie Industrială, clasa a XII-a liceu tehnologic, numărul Anexa 4121/13.06.2016. Este o părere personală.
Bibliografie:
- Daniela Stănescu, Ana Rus; Ruxandra Lixandru, Constanța Pătrulescu, Luminița Bertalan, Miruna Miteanu, Instrumente și tehnici de laborator, clasa a X-a Liceu Tehnologic, profilul: Resurse naturale și protecția mediului, Editura LVS, an 2005
- https://muhaz.org/fis-de-documentare.html
- https://www.academia.edu/9782090/USTENSILE_DE_LABORATOR?auto=download
- https://dokumen.tips/documents/ganescu-ion-lucrari-de-laborator-de-chimie-generalapdf.html
USTENSILE-LABORATOR-UZUALE
MODULUL: OPERAŢII DE BAZĂ ÎN LABORATOR (clasa a -XI -a)
CICLUL SUPERIOR AL LICEULUI TEHNOLOGIC
DOMENIUL: PROTECȚIA MEDIULUI
CALIFICAREA: TEHNICIAN ECOLOG SI PROTECTIA CALITATII MEDIULUI
Acest material a fost elaborat prin finanțare Phare în proiectul de Dezvoltare instituțională a sistemului de învățământ profesional și tehnic
Noiembrie 2008
AUTORI
Prof. BOCHIS CARMEN ADRIANA – Colegiul Tehnic de Construcții si Protecția Mediului ARAD.
Prof. Ing. MICALACIAN LUCICA -Colegiul Tehnic de Construcții si Protecția Mediului ARAD.
Prof. SARB IOAN – Colegiul Tehnic de Construcție si Protecția Mediului ARAD.
☺
Vă recomand acest curs, cu încredere!
MODULUL: OPERAŢII DE BAZĂ ÎN LABORATOR (clasa a -XI -a)Operatii de baza in laborator
REBUS APARATE ȘI PRINCIPII DE BAZA ÎN METODELE DE ANALIZĂ INSTRUMENTALĂ
Celor interesați, le propun acest rebus, pentru recunoașterea unor aparate, respectiv a unor principii din Analiza Instrumentală. Este un punct de vedere personal. În imaginea de mai jos, vedeți o frântură din rebus.
Link-ul de accesare este:
https://crosswordlabs.com/embed/principiu-ustensile-din-analiza-instrumentala-clasa-a-xii-liceu
TRATAREA STATISTICĂ A DATELOR ANALITICE ÎN CHIMIA ANALITICĂ
Sunt probleme rezolvate despre aplicarea testelor statistice: t (STUDENT); F; chi pătrat, Q, în aprecierea rezultatelor unor analize chimice ale aceleași mărimi.
CHIMIE ANORGANICA MODELE DE EXERCITII
CRITERII DE ELIMINARE_PRELUCRAREA STATISTICĂ A DATELOR EXPERIMENTALE
După, obținerea rezultatului unei analize chimice cantitative apare și întrebarea:” este acesta sau nu sigur și acceptabil ?”.
Vă propun următoarele criterii statistice de eliminare valori îndoielnice de la măsurarea unei mărimi fizico-chimice, precum:
- testul t Student;
- raportul X/s;
- testul F (Fisher)
- testul Anova
- criteriul Q (Dixon)
Este o părere personală, vreau să ajut la înțelegerea acestor calcule de eliminare a datelor, care nu sunt sigure. Nu contrazic pe nimeni.
EVALUAREA MATEMATICĂ A ERORILOR DIN DETERMINĂRILE EXPERIMENTALE, PRIN CRITERIUL DE ELIMINARE, RAPORTUL X/s
-problemă rezolvată- 7 iulie 2020
Argument
Celor interesați, le ofer acest model de prelucrarea statistică a datelor analitice, când se pune problema să fie respinsă o măsurătoare, dintr-o serie de măsurători, pentru aceeași mărime fizică sau chimică. Nu vreau să fiu judecată, de o abordare simplistă.7
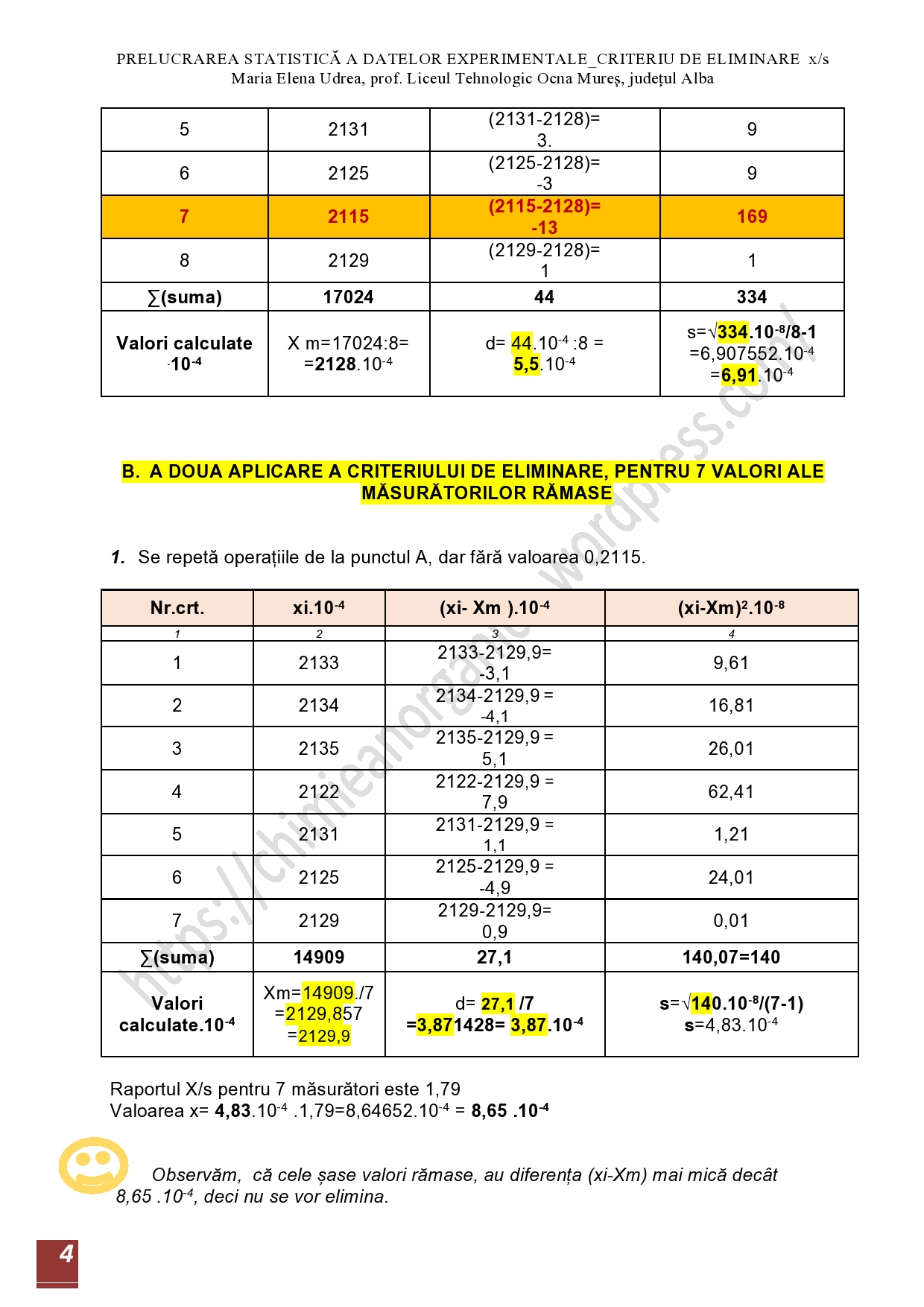

APRECIEREA UNEI METODE DE ANALIZĂ DUPĂ REZULTATELE OBȚINUTE PE ACEEAȘI PROBĂ PRIN TESTUL…
Vezi articolul original 632 de cuvinte mai mult
EROAREA ABSOLUTĂ ȘI INCERTITUDINEA




















































