* Nu mă pot aștepta, să te convingi de un lucru, de care eu nu sunt convinsă!*
☺Există la ora actuală, multă informație despre numărul de oxidare (N.O). În acest material prezint exerciții rezolvate, pentru calcularea N.O, la unii reactivi chimici din analiza volumetrică, cu ajutorul desenelor, pentru structura atomului și a ionul său.
Am găsit o definiție dată N.O. și anume: un număr de oxidare este sarcina electrică atribuită fiecărui element din combinația sa chimică ionică și covalentă, presupunând că sunt formate numai din ioni și electronii de legătură sunt atrași mai mult de partenerul electronegativ, din combinația chimică. Numărul de oxidare se notează cu un număr pozitiv, negativ sau 0, care se scrie în partea dreaptă sus, a elementului, și este stabilit pe baza unor reguli. Numărul de oxidare explică mai bine față de valență, capacitatea de combinare a unui element, prin numărul maxim sau minim de electroni, pe care îi cedează sau îi acceptă, într-o reacție chimică, pentru a-și forma configurație stabilă de octet, respectiv dublet.
Pentru înțelegerea termenilor din reacțiile de oxido-reducere, trebuie să înțelegi prima dată: legătura dintre sistemul periodic ale elementelor și proprietățile elementului, termenii de reacție chimică, ecuație chimică, reactant, produs de reacție, ce este un ion, calcule algebrice cu numere negative și numere pozitive. Să nu uităm să ne răspundem la întrebarea:* -La ce mă ajută, aceste noțiuni?*
EXERCIȚII REZOLVATE
☺ Ex. 1.Numerele de oxidare la Hidrogen, reactiv HCl, H2O2

Ex.2 Stabiliți coeficienții reacției redox:
☺
?H2O2 + ?KClO = ?KCl + ?H2O + ?O2↑
Se aplică etapele de stabilire coeficienți la o reacție redox, învățate la Chimie și anume:
►se scriu N.O la toate elementele și se subliniază elementele care-și modică N.O. Se cunosc regulile de stabilire N.O. Oxigenul și clorul își modifică numerele de oxidare în reacție.
REACTANȚI PRODUȘI DE REACȚIE
H+2O2– + K+ Cl+ O2- = K+ Cl– + H+2 O2- + O20
►se observă că: un ion O– cu N.O=-1 , din H2O2 trece în atomul O0 cu N.O.=0, prin cedare de 1 e -; fiindcă avem 2 ioni de O– și se formează o moleculă de O2, se vor ceda 2 e–, unui ion Cl+. Procesul se numește oxidare (dare de electroni).
►se observă că un ion de Cl+ cu N.O=+1 din KClO trece în ionul Cl1- din KCl, cu N.O=-1 prin acceptare de un electron, de la un ion O-1. Procesul se numește reducere (cerere de electroni).
►se scriu cele două procese de reducere și oxidare și se adună algebric, respectând legea conservării numărului de electroni:
n e– acceptați = n e- cedați.
Cl+ + 2e- = Cl– reducere
ag.red ag.ox
2O– – 2e– =O02 oxidare
ag.ox ag. red
∑: ecuație de reducere + ecuație de oxidare=
Cl+ +2 e– +2O– -2e– = Cl– +O02
Rezultă coeficienții ecuației date: 1 pentru Cl+ din KClO și 1 pentru H2 O2–,
Axa numerelor pozitive și negative
…………………..-2…☺-1.►…...0…☺...+1……☺+2……………………………………………….
O–→O0 /oxidare, cedează 1 e(-);N.O crește de la -1 la 0, cu 1
Cl- ←Cl0←Cl+/reducere, N.O scade de la +1la -1, cu 2.
R: Ecuația reacției chimice corecte este:
H2O2 + KClO = KCl + H2O + O2↑
Ex. 3.Stabiliți coeficienți acestei reacții: ☺
? C + ?H2 S O4 = ? C O2 + ? S O2 + ? H2 O
Corect:
C + 2 H2 S O4 = CO2 + 2 SO2 + 2 H2 O
 Rezolvare
Rezolvare
►se scriu N.O la toate elementele și se subliniază elementele, care-și modică N.O. Se cunosc regulile de stabilire N.O. Sulful și carbonul își modifică numerele de oxidare în reacție.
REACTANȚI PRODUȘI DE REACȚIE
? C0 + ?H2 + S6+ O42- = ? C4+ O22- + ? S4+ O22- + ? H2 + O2-
►se observă: un atom de C cu N.O=0 , din C trece în ionul C4+ cu N.O.=+4, prin cedare de 4 e-. Procesul se numește oxidare (dare de electroni).
►se observă că un ion de S6+ cu N.O=+6 din H2SO4 trece în ionul S 4+ din SO2, cu N.O=+4 prin acceptare de doi electroni, de la un atom de C, dar C cedează 4 e– și atunci trebuie să fie 2 ioni de S6+ pentru a-i primi (fiecare primește câte 2). Procesul se numește reducere (cerere de electroni).
►se scriu cele două procese de reducere și oxidare (semireacții) și se adună algebric, respectând legea conservării numărului de electroni:
n e– acceptați = n e- cedați.
C0 – 4e- = C4+ oxidare
ag.ox ag.red
S6+ + 2e– = S4+ reducere /.2
ag.red. ag. ox
∑: ecuație de reducere + ecuație de oxidare=
C0 -4 e–+2S6+ 2.2 e–=C4+ + 2S4+
Rezultă coeficienții ecuației date: 1 pentru C și 2 pentru S6+ din H2SO4, 1 pentru C4+ din CO și 2 pentru S4+ din SO2.
☺Exercițiul 4 .Acidul azotic este un oxidant important. În reacția cu metalele el reacționează diferit în funcție de natura metalului și de concentrația soluției acide. La următoarele procese chimice, stabiliți coeficienții stoechiometrici:
(Bibliografie: V. Sohoran, Probleme de chimie)
- ? Ca +? HNO3 (diluat)= ? Ca(NO)3 +? H2↑
- ?Hg +? HNO3 = ? Hg(NO3)2 +? NO2 + ? H2O
- ?Cu +? HNO3 =? Cu(NO3)2 + ? NO + ? H2O
- ?Ni + ? HNO3 fierbere= ?Ni (NO3)2 + ?NO + ?H2O
- ?Zn + ?HNO3 (30%) = ?Zn (NO3)2 +?N2O + ?H2O
- ? Zn + ?HNO3 (soluție diluată) = ?Zn (NO3)2 + ?NH4NO3 +?H2O
- ?Co + ?HNO3 (soluție foarte diluată) =?Co (NO3)2 + ?N2 + ?H2O
- ? C + ? HNO3 (concentrat, peste 60%) la cald= ? NO +? CO2 + ? H2O
- ? S+ ? HNO3(concentrat, la cald) =? NO + ? H2SO4
- ? P + ? HNO3 (concentrat, la cald) + H2O= ? NO +? H3PO4
- ? Ag + ? HNO3 concentrat, la cald= ? AgNO3 +? NO + ? H2O
- ?Au + HNO3+3 HCl = ? AuCl3 + ? NO+ ? H2O
- ?MnSO4 + ?PbO2 + ?HNO3 = ?HMnO4 +? Pb(NO3)2 + ?PbSO4 +? H2O
- ?HNO3 (soluție) sub acțiunea luminii, la aer = ?NO2↑ + ? H2O +?O2
Rezolvarea propusă la exercițiul 4.1.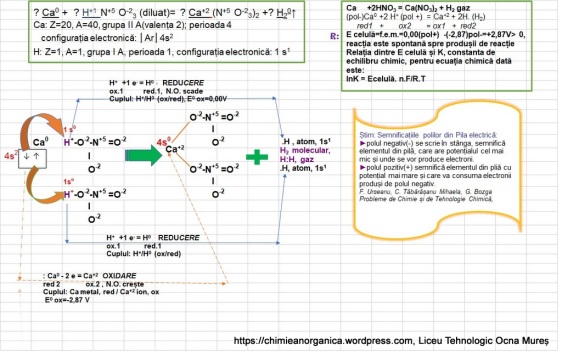
☺Rezolvarea propusă la exercițiul 4.3
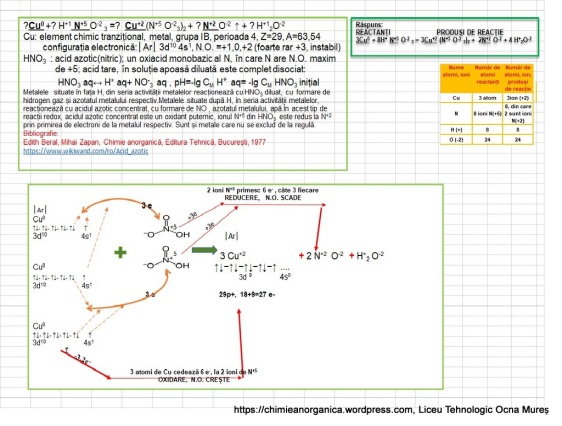
?Cu0 +? H+ N+5 O-2 3 =? Cu+2 (N+5 O-2 3)2 + ? N+2 O-2 + ? H+2O-2
Parcurgem etapele de stabilire coeficienți la o reacție redox, învățate la Chimie, respectiv Chimie Analitică.
►Elementele care își modifică N.O. sunt Cu și N.
►Scriem reacțiile chimice, prin care atomul de Cu trece în ion de Cu(II) și ionul de N(+5) trece în ion de N(+2). Aceste reacții se numesc semireacții în reacția redox, de mai sus.
Cu0 – 2 e– (unul din 4s1 și unul din 3d10) → Cu2+ OXIDARE, / x 3
Ag. red 1 Ag.ox 1
N.O. al Cu crește în procesul de oxidare, de la 0 la +2!
N+5 + 3 e– (primește de la 2 atomi de Cu) → N+2 REDUCERE/x2
Ag.ox.2 Ag. red.2
N.O. al ionului N scade în procesul de reducere, de la +5 la +2.
► Egalăm numărul de electroni cedați și primiți (bilanțul de electroni), prin înmulțire cu cifrele 3 (la Cu) și 2 (la N) și apoi vom aduna aceste semireacții. Rezultă:
3Cu0 -3.2e– +2N+5+2.3e– → 3Cu+2 + 2N+2
Coeficienții stoechiometrici sunt: 3 la Cu și 3 la ionul Cu(+2) și 2 la ionul N(+5) și 2 la ionul N(+2).
►Introducem coeficienții de mai sus în reacția totală și egalăm restul numărului de atomi de: H, O. Înțelegem că intră un număr mai mare de ioni N(+5), față de 2, fiindcă o parte din el trece în Cu(NO3)2.
REACTANȚI PRODUȘI DE REACȚIE
3Cu0 + 8H+ N+5 O-2 3 = 3Cu+2 (N+5 O-2 3)2 + 2N+2 O-2 + 4 H+2O-2
red1 ox2
♣ Tabel cu bilanțul numărului de atomi, ioni
| Nume atomi, ioni
|
Număr de atomi reactanți | Număr de atomi, ion,produși de reacție |
| Cu | 3 atom | 3ion (+2) |
| N | 8 ioni N(+5) | 8, din care 2 sunt ioni N(+2) |
| H (+) | 8 | 8 |
| O (-2) | 24 | 24 |