Este un punct de vedere personal. Nu contrazic alte variante de rezolvare.
NOȚIUNI
►NOTAȚII
- B=soluția reactiv, de concentrație cunoscută, numită și soluție titrată, titrant
- A=substanța de analizat, pură
►Ecuația chimică generală,dintre titrant și substanța de analizat este:
B (titrant) + A (substanța de analizat, dozat)=C (produși de reacție)
►Conceptul de TITRU ÎN RAPORT CU SUBSTANȚA DE ANALIZAT, A UNEI SUBSTANȚE REACTIV FOLOSITĂ LA TITRARE
- notare: T B/ A,(g/mL);unde linia / semnifică:raportat,în raport cu ceva, cineva
- definim titrul soluției titrant B, în raport cu substanța de analizat,A, ”T B/A”, numărul care arată cantitatea din substanța de analizat, A, exprimată în grame, echivalentă cu cantitatea de titrant B, care se află în 1 mL soluție de titrant, B.
(adică: numărul de echivalenți gram de B din 1 mL soluție B= numărul de echivalenți gram de A)
► Relația matematică pentru calcularea lui T B/ A,când se cunoaște T B
T B/A=(T B (g/mL). Eg A)/Eg B
Eg B=echivalent gram al titrantului B
Eg A=echivalent gram al substanței de analizat
Eg B și E g A se calculează cu regulile învățate, când substanța participă la reacții de neutralizare și redox.
-
EXERCIȚII REZOLVATE PENTRU PATRU TIPURI DE REACȚII CHIMICE
-
ÎNTÂLNITE ÎN ANALIZA VOLUMETRICĂ
TIPURI DE REACȚII CHIMICE ÎN ANALIZA VOLUMETRICĂ
Reacția de neutralizare
Reacția de oxido-reducere (redox)
Reacția de precipitare
Reacția de complexare
DEMONSTRAREA RELAȚIEI MATEMATICE PENTRU CALCULAREA LUI T B/A
O soluție de NaOH are titrul egal cu 0,043522 g/mL. Să se calculeze titrul acestei soluții în raport cu HCl, T NaOH/ HCl. .
Rezolvare
Notăm:
HCl=substanța de analizat,A
NaOH = titrant,B
T B/A=T NaOH/HCl=titrul soluției de NaOH în raport cu HCl
Știm:
►Titrul soluției de NaOH=T NaOH=0,043522 g/mL
►între NaOH și HCl are loc o reacție de neutralizare:
NaOH+HCl=NaCl+H2O
►Cum se aplică conceptul de ”T B/ A,(g/mL)” la problema de față?
-Prima dată, trebuie să calculăm câți Echivalenți gram de HCl corespund la numărul de Eg de NaOH din 1 mL soluție de NaOH cu titrul de 0,043522(g/mL)!
nEg NaOH din 1 mL soluție = nEg HCl
–Apoi, vom calcula cantitatea de HCl (g) din 1 mL, din numărul de echivalenți gram de HCl!
Această cantitate de HCl g/mL este T NaOH/HCl
►Ce este echivalentul gram?
Eg NaOH=echivalentul gram NaOH
Eg NaOH=Masa moleculară NaOH/număr de grupări OH
Eg NaOH=M NaOH(g/mol)/1=M NaOH=40
Eg HCl=echivalentul gram HCl
Eg HCl=Masa moleculară HCl/număr de protoni cedați H (+)
Eg HCl=M HCl/1=M HCl=36,5
Nu știm și trebuie să calculăm:
-cantitatea de NaOH (g) din 1 mL soluție=m NaOH=?,g
-nEg NaOH=?
-nEg HCl=?
-cantitatea de HCl echivalentă=? g/mL
-T HCl/NaOH=?(g/mL)
Calcule. Etape:
►m NaOH o calculăm din titrul, T NaOH (g/mL), cu definiția lui
Potrivit definiției titrului:
1mL soluție NaOH are 0,043522 g NaOH dizolvat.
►n Eg NaOH=m NaOH/M NaOH
n Eg NaOH=0,043522 g/ 40(g/mol)=0,0010881/1 mL soluție de NaOH
►nEg HCl este egal cu nEg NaOH/1mL
Rezultă că:nEg HCl=0,0010881
►m HCl/1mL=?
m HCl=nEg HCl.Eg HCl
m HCl=0,0010881.36,5=0,039713 g
Formula de calcul ♠
T B/A=(T B (g/mL). Eg A)/Eg B
T NaOH/HCl/=(0,043522 g/mL.36,5)/40=0,039713 g/mL
TIP REACȚIA DE NEUTRALIZARE
Titrul unei soluții de Na2B4O7. 10 H2O este 0,019069 g/mL. Să se calculeze titrul acestei soluții în raport cu HCl, T Na2B4O7. 10 H2O/HCl.
****
În analiza volumetrică bazată pe reacții de neutralizare, boraxul (Na2B4O7. 10 H2O) este o substanță etalon, care formează soluții de concentrație exactă, numite și etalon.
Factorul soluției de HCl, de concentrație aproximativă 0,1 N, se determină prin titrare cu soluția 0,1 N de Na2B4O7. 10 H2O, în prezența indicatorului acido-bazic metiloranj sau roșu de metil.
Rezolvare
Notăm astfel:
HCl=substanța de analizat,A
Na2B4O7. 10 H2O=titrant,B
T B/A=T Na2B4O7. 10 H2O/HCl=titrul soluției de Na2B4O7. 10 H2O în raport cu HCl
Știm:
►Titrul soluției de Na2B4O7. 10 H2O=T Na2B4O7. 10 H2O=0,019069 g/mL
►Reacțiile chimice din timpul titrării sunt:
a)reacția de hidroliza bazică a Na2B4O7 în soluție apoasă:
Na2B4O7 + 7 H2O ↔ 2 NaOH + 4 H3BO3
1mol de Na2B4O7 produce 2 moli de NaOH, bază tare.
H3BO3 este un acid slab, la care Ka este 6,0.10-10 și nu va influența semnificativ rezultatele titrării.
b)reacția de neutralizare dintre cei 2 moli de NaOH formați cu HCl, existent în paharul Erlenmayer:
2NaOH+2HCl→2NaCl+2H2O
⇒ Reacția globală din timpul titrării este:
Na2B4O7 + 2 HCl + 5 H2O→ 2NaCl + 4 H3BO3
►Punctul de echivalență este dat de virajul culorii indicatorului acido-bazic, metiloranj, în acest caz.
► La punctul de echivalență:
număr Eg de Na2B4O7 =număr de Eg de H3BO3
Eg=echivalent gram
Eg la Na2B4O7=190,686
Eg la HCl=36,458
Calcul T Na2B4O7/HCl cu expresia matematică
T B/A=(T B(g/mL).Eg A )/Eg B
T Na2B4O7 / HCl =0,019069 g/mL.36,458/190,686=0,003646 g/mL aprox
R: T Na2B4O7 / HCl =0,003646 g/mL
TIP REACȚIA DE PRECIPITARE
Câte grame de clor se găsesc într-o soluție de NaCl, dacă la titrarea s-au consumat 19,95 mL soluție de AgNO3, , la care titrul T AgNO3/Cl=0,03640 g/mL. Dozarea clorurii de sodiu are loc cu metoda MOHR, indicator al punctului de echivalență este cromatul de potasiu,soluție.
Rezolvare
Notăm astfel:
-ionul de Cl(-),din NaCl=ionul de analizat,A
-masa de Cl(-)=?(g) X (g)
AgNO3,=titrant,B
T B/A= T AgNO3, /Cl(-)=titrul soluției de AgNO3, în raport cu ionul de Cl(-)
Știm:
► T AgNO3, /Cl=0,03640 g/mL
► Volumul soluției de AgNO3, =Vs AgNO3, =19,95 mL
►Metoda Mohr se bazează pe următoarele reacții chimice:
-reacția de titrare:
Ag+(reactiv)+Cl–(substanța de analizat) ↔ AgCl↓ alb
-reacția de indicare, pE:
2 Ag+ + CrO42- ↔ Ag2 CrO4 ↓ roșu
Ks AgCl=1,8 .10-10
Ks Ag2CrO4 =8,2.10-12
►Eg AgNO3 =M AgNO3=169,875
►Eg Cl(-) =35,457
Etape de calcul
☺calculăm titrul de Ag(+ ) cu expresia matematică:
T B/A=(T B (g/mL).E g A )/Eg B
T AgNO3/Cl =T AgNO3.Eg Cl (-)/Eg AgNO3
0,03640 g/mL =TAgNO3.35,457/169,875
0,03640 g/mL . 169,875=T AgNO335,457
T AgNO3=6,18345 g/mL/35,457=0,174393 g/mL
☺calculăm masa de AgNO3 grame din 19,95 mL soluție AgNO3
m AgNO3=T AgNO3.Vs de AgNO3=0,174393 g/mL.19,95=3,47913887 g≈3,4791g
☺calculăm masa de Cl(-), X (g), cu legea echivalenților:
nEg AgNO3=nEg Cl(-)
m AgNO3/Eg AAgNO3=X/Eg Cl(-)
3,4791g/169,875=X/35,457
3,4791.35,457=X.169,875
X=0,72617≈0,7262 g de ion Cl(-)
Rezultă că:
R: 0,7262 g de ion Cl(-)
TIP REACȚIA REDOX
Din 0,7120 g cristalohidrat de oxalat de amoniu se prepară într-un balon cotat 200 mL soluție. Pentru titrarea a 25 mL din această soluție sunt necesari 18,90 mL soluție de KMnO4, mediu puternic acid, de H2SO4.Să se calculeze T KMnO4/Fe2+, pentru titrarea în mediu acid.(titrul soluției de KMnO4, în raport cu Fe2+).
Rezolvare
Explicație
a)Avem o soluție de KMnO4, de o anumită concentrație necunoscută, exprimată sub formă de titru (g/mL), care titrează o soluție de C2O4(NH4)2.2H2O, de volum și concentrație cunoscută (sau număr de echivalenți).În timpul titrării are loc reacția chimică redox dintre C2O4(NH4)2.2H2O cu KMnO4 în mediu acid. Indicator al punctului de echivalență este chiar soluția de KMnO4.
Forma ionică a ecuației chimice este compusă din semireacțiile de:
–reducere:
(Mn7+ O4 2-)– + 5 e– +8 H+ → Mn2+ + 4H2O / .2
KMnO4= agent oxidant Mn2+= agent reducător
–oxidare:
(O22- C3+ – C3+ O22- )2- – 2 e– → 2 C4+ O22- / .5
C2O4(NH4)2.2H2O=agent reducător; CO2= agent oxidant
număr de e- cedați=număr de e- acceptați
►2MnO42- + 10e- + 16 H+ + 5C2O42- -10 e– → 2Mn2+ +8 H2O + 10 CO2
Ecuația chimică a reacției chimice este:
***
2KMnO4 +8 H2SO4 + 5C2O4 (NH4)2 → 2MnSO4+K2SO4+5(NH4)2SO4+8 H2O+10 CO2
b) Aceeași, soluție de KMNO4, cu titrul calculat mai sus, titrează o soluție ce conține ionul Fe(2+), în mediu acid. În timpul titrării are loc reacția chimică redox dintre ionul Fe(2+) cu KMnO4 în mediu acid.
Ecuația ionică forma redusă este:
5Fe2+ + Mn5+O42- + 8H+ ↔ Mn2+ + 5 Fe3+ + 4H2O
Fe2+=agent reducător
KMnO4=agent oxidant
Baza calculării T KMnO4/Fe
▼Se aplică relația matematică:
T KMnO4/Fe2+ =T KMnO4.Eg Fe2+ /Eg KMnO4
unde:
♠T KMnO4=titrul soluției de KMnO4 (g/mL),care reacționează cu C2O4(NH4)2.2H2O, adus de 25 mL soluție, extrasă din balonul cotat, unde s-au dizolvat 0,7120 g de C2O4(NH4)2.2H2O.
♠Eg Fe2+ =echivalentul gram al ionului Fe2+ în reacția chimică redox cu KMnO4
♠Eg KMnO4=echivalentul gram al KMnO4, în reacția chimică redox cu Fe2+ și C2O4(NH4)2.2H2O, în mediu acid
▼
T KMnO4 se calculează cu ajutorul legii echivalenților pentru reacția chimică cu C2O4(NH4)2.2H2O, și a relației matematice pentru Titru:
n Eg KMnO4=nEg C2O4(NH4)2.2H2O
T =md KMnO4(g)/Vs(mL)
unde:
nEg KMnO4=număr de Eg de KMnO4
nEg C2O4(NH4)2.2H2O=număr de Eg de C2O4(NH4)2.2H2O
Etape de calcul
♫ Notăm cu:
X=masa de C2O4(NH4)2.2H2O din 25 mL soluție, care se va titra
Y=masa de KMnO4 consumat în reacție de,X, g de C2O4(NH4)2.2H2O
► calculăm masa de C2O4(NH4)2.2H2O, X, din 25 mL soluție, dacă în 200 mL soluție se dizolvă 0,7120 g de C2O4(NH4)2.2H2O , cu regula de trei simplă.
dacă în 200 mL soluție………….sunt…….. 0,7120 g de C2O4(NH4)2.2H2O dizolvat
atunci în 25 mL soluție…………….sunt……….X, g,
X=25 mL.0,7120 g/200 mL=0,7120/4=0,1780 g de C2O4(NH4)2.2H2O
►calculăm masa de KMnO4,Y, consumat în reacția redox de 0,1780 g de C2O4(NH4)2.2H2O, cu legea echivalenților:
n Eg KMnO4=nEgC2O4(NH4)2.2H2O
unde:
nEg de KMnO4=masa de KMnO4/E KMnO4 pentru reacția redox
Eg KMnO4=M KMnO4 /număr de e- acceptați=158 g/mol /5=31,6
►n Eg KMnO4=X/31,6
***
nEg de C2O4(NH4)2.2H2O=masa C2O4(NH4)2.2H2O/Eg C2O4(NH4)2.2H2O
masa de C2O4(NH4)2.2H2O=0,1780 g
Eg C2O4(NH4)2.2H2O=M C2O4(NH4)2.2H2O/ 2.1 e- cedați
M C2O4(NH4)2.2H2O=2.A C+4.AO+2.A N+8.A H+2.M H2O=142 g/mol
Eg C2O4(NH4)2.2H2O=142/2=71
2=număr de C(3+),care cedează fiecare câte 1 e-
►n Eg C2O4(NH4)2.2H2O =0,1780 /71
Rezultă din legea echivalenților:
X/31,6=0,1780/71
X=31,6.1,253.10-3
m KMnO4=X=31,6.1,253.10-3 g
►calculăm T KMnO4:
T KMnO4=md KMnO4/Vs KMnO4=31,6.1,253.10-3 g/18,9mL
= 31,6.0,06629.10-3 (g/mL)
►calculăm T KMnO4/Fe2+ cu expresia matematică:
T KMnO4/Fe2+ =T KMnO4.Eg Fe2+ /Eg KMnO4
Eg Fe2+ =A Fe2+ /număr de electroni cedați
Eg Fe2+ =56/1=56
T KMnO4/Fe2+ =31,6.0,06629.10-3 (g/mL).56/31,6=3,712592.10-3
►T KMnO4/Fe2+ =0,0037126
R:0,0037126
TIP REACȚIA DE COMPLEXARE
Determinarea halogenurilor solubile cu Hg(NO3)2 – Mercurimetria
Mercurimetria include metode titrimetrice, bazate pe formarea unor combinații complexe dintre (Hg(NO3)2 titrant și ionii de analizat, precum Cl-, Br-, I-, SCN-.
Un indicator al punctului de echivalență poate fi difenilcarbazona (pH =3,2-3,3), împreună cu bromofenol, pentru a regla pH-ul și care cu Hg2+. Se formează un complex, de culoare violet. Se lucrează la pH acid (adăugare de HNO3), pentru evitarea hidrolizei Hg2+.
Factorul de corecție al concentrației soluției de Hg(NO3)2 se stabilește prin titrare cu o soluție titrofixă de NaCl.
DOZAREA IODURII DE POTASIU PRIN TITRARE CU SOLUȚIE DE AZOTAT DE MERCUR
20 mL de soluție ce conține KI se titrează cu 15,5mL soluție de Hg(NO3)2, 0,1 M, cu factorul de corecție pentru concentrație, F=1,0081.a)Scrieți reacțiile chimice, ce au loc în timpul titrării; b)Calculați T KI (g/mL);c) Determinați T Hg(NO3)2 /KI.
Rezolvare
a) Au loc următoarele reacții chimice:
Reacțiile chimice sunt complexe, dar pentru calcule analitice se acceptă următoarele.
momentul 1:până la pE: exces de KI
În paharul de titrare, există:
-ioni de I– și de K+ neconsumați din soluția de analizat;
-precipitatul HgI2, de culoare roșie, instabil în exces de ioni I(-),fiindcă suferă reacții de complexare;
complexul [HgI4 ]2-. Se admite existența unor complecși inferiori instabili.
Hg(NO3)2 +2KI=HgI2↓+2KNO3
HgI2↓ +2 KI =K2 + [HgI4 ]2-
moment 2: la pE
Ionii de I- s-au consumat și există ionul complex [HgI4 ]2-.
Este valabilă legea echivalenților:
nEg KI=nEg de Hg(NO3)2
moment 3, peste pE; este exces de Hg(NO3)2 .
Dacă se adaugă din biuretă Hg(NO3)2 ,complexul [HgI4 ]2- este descompus, cu formarea precipitatului HgI2:
[HgI4 ]2-+ Hg2+ ↔ 2HgI2 precipitat
Titrarea se oprește la apariția precipitatului HgI2,de culoare roșie.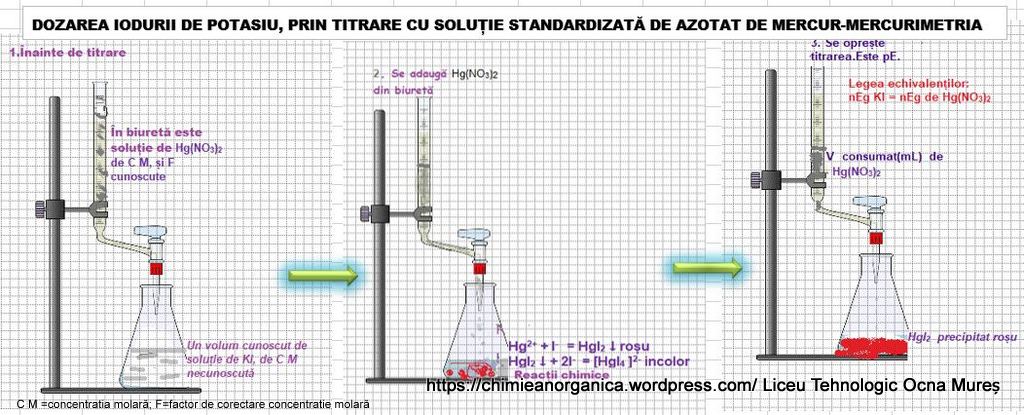
b) Titrul, T al soluției KI,dacă volumul soluției este 20 mL
b1) Explicații
Se aplică relația matematică:
T KI=md KI/Vs (g/mL)
unde:
md KI=masa dizolvată de KI (g) în 20 mL
Vs= volumul soluției de KI=20 mL
► Nu știm md KI și se calculează cu legea echivalenților, la momentul punctului de echivalență, de la titrarea cu Hg(NO3)2:
nEg de KI=nEg de Hg(NO3)2
nEg=număr de echivalenți gram de Ki, respectiv Hg(NO3)2
nEg=md/Eg
Eg KI și respectiv Eg Hg(NO3)2 se calculează cu expresia matematică pentru săruri, când nu participă, la reacții redox:
Eg KI=M KI/număr de K(metal).valența K
Eg Hg(NO3)2 = M Hg(NO3)2 / număr de Hg(metal).valența Hg
………………………………………………………………………………………………
b2) Etape de calcul
►Calcul de md de Hg(NO3)2 (g) din 15,5 mL soluție de concentrație molară 0,1 M și F=1,0081, astfel:
C M=md Hg(NO3)2 /M Hg(NO3)2 .Vs.F (mol/L)
M Hg(NO3)2 =A Hg + 2.AN + 6.A O=201+2.14+6.16=201+28+96=325g/mol
Rezultă:
0,1 mol/L=md/325g/mol.15,5.10exp-3L.1,0081
md Hg(NO3)2 =0,1.325g.15,5.10exp-3.1,0081=0,5078 g
► Calcul Eg de Hg(NO3)2
Eg Hg(NO3)2 =M Hg(NO3)2 /2.1=325/2=162,5 g
► Calcul nEg de KI, din legea echivalenților:
nEg KI=nEg Hg(NO3)2 =0,5078/162,5=3,1249.10exp-3
► Calcul md de KI (g)
md KI=nEg KI.Eg KI
Eg KI=M KI/1.1= M KI=A K+ A I=39+127=166g
Rezultă:
md KI=3,1249.10-exp3 .166=0,5187 g
► Calcul T KI (g/mL)
T KI=0,5187g/20 mL=0,02594 g/mL
R: 0,02594 g/mL
*******************************************
c) Calcul T Hg(NO3)2 /KI
Explicații
c1) Se aplică relația matematică:
T Hg(NO3)2 /KI=T Hg(NO3)2 . Eg KI/Eg Hg(NO3)2
unde:
T Hg(NO3)2 =titrul soluției de Hg(NO3)2 (g/mL)
Eg Hg(NO3)2 =echivalentul gram Hg(NO3)2
Eg KI=echivalentul gram la KI
c2) Se calculează Hg(NO3)2 astfel:
T Hg(NO3)2 =md Hg(NO3)2/Vs (g/mL)
T Hg(NO3)2 =0,5187 g/20 mL=0,025935 aprox 0,0259 g/mL
Rezultă:
T Hg(NO3)2 /KI=0,0259 g/mL.166/162,5 g=0,02646 g/mL
R: 0,02646 g/mL
BIBLIOGRAFIE
1.Conf. Dr. Maria Mitrănescu, Curs de Chimie Analitică cantitativă, Institutul Politehnic ”Traian Vuia”, Timișoara, 1979
2. https://chimieanalytique.com/mercurimetrie/
3.https://images.app.goo.gl/xK2nrCgZFyQpPr5Q6
4. https://www.youtube.com/watch?v=FVmKKqce_Qg